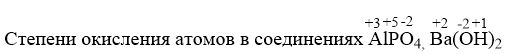Материалы по запросу: aipo4
Определите степень окисления химических элементов в соединениях Mn2O7, K2CrO4, NaNO2, AIPO4, FeCI3…
Определите степень окисления химических элементов в соединениях Mn2O7, K2CrO4, NaNO2, AIPO4, FeCI3
Ответ на вопрос
Mn2O7: марганец имеет степень окисления +7
K2CrO4: калий имеет степень окисления +1, хром имеет степень окисления +6, кислород имеет степень окисления -2
NaNO2: натрий имеет степень окисления +1, азот имеет степень окисления +3, кислород имеет степень окисления -2
AlPO4: алюминий имеет степень окисления +3, фосфор имеет степень окисления +5, кислород имеет степень окисления -2
FeCl3: железо имеет степень окисления +3, хлор имеет степень окисления -1
Еще
49
1
Установите соответствие между уравнениями реакций и ошибками в их написании уравнения реакций ошибки а) CaO+2HSO4=CaSO4+H2O…
HCI+NaOH=NaCI+H2O 2) в 2 формулах и расстановке коэффициентов в) HPO4+AI(OH)3=AIPO4+H2O 3) в расстановке коэффициентов
Ответ на вопрос
а) - 1) в формуле и расстановке коэффициентов
б) - 3) в 2 формулах и расстановке коэффициентов
в) - 2) в расстановке коэффициентов
Еще
142
1
Определите степени окисления каждого элемента в соединениях CrO3,K2Cr2O7,H3PO4,CuSO4,AIPO4…
Определите степени окисления каждого элемента в соединениях CrO3,K2Cr2O7,H3PO4,CuSO4,AIPO4
Ответ на вопрос
Определим степени окисления элементов в указанных соединениях.CrO3 (Хром(VI) оксид):Сера (O) имеет степень окисления -2.Пусть степень окисления хрома (Cr) будет x.
[
x + 3(-2) = 0 \
x - 6 = 0 \
x = +6
]Cr: +6; O: -2K2Cr2O7 (Дихромат калия):Калий (K) всегда имеет степень окисления +1.Сера (O) имеет степень окисления -2.Пусть степень окисления хрома (Cr) будет x.
[
2(+1) + 2x + 7(-2) = 0 \
2 + 2x - 14 = 0 \
2x - 12 = 0 \
2x = 12 \
x = +6
]K: +1; Cr: +6; O: -2H3PO4 (Ортофосфорная кислота):Водород (H) имеет степень окисления +1.Кислород (O) имеет степень окисления -2.Пусть степень окисления фосфора (P) будет x.
[
3(+1) + x + 4(-2) = 0 \
3 + x - 8 = 0 \
x - 5 = 0 \
x = +5
]H: +1; P: +5; O: -2CuSO4 (Сульфат меди(II)):Кислотные остатки:
Сера (S) имеет степень окисления +6.Кислород (O) имеет степень окисления -2.Пусть степень окисления меди (Cu) будет x.
[
x + (+6) + 4(-2) = 0 \
x + 6 - 8 = 0 \
x - 2 = 0 \
x = +2
]Cu: +2; S: +6; O: -2AlPO4 (Фосфат алюминия):Алюминий (Al) всегда имеет степень окисления +3.Фосфор (P) пусть будет x.Кислород (O) имеет степень окисления -2.
[
(+3) + x + 4(-2) = 0 \
3 + x - 8 = 0 \
x - 5 = 0 \
x = +5
]Al: +3; P: +5; O: -2Таким образом, итоги по соединениям:CrO3: Cr +6, O -2K2Cr2O7: K +1, Cr +6, O -2H3PO4: H +1, P +5, O -2CuSO4: Cu +2, S +6, O -2AlPO4: Al +3, P +5, O -2
Еще
23
1
Задача по химии Формула вещества aipo4 n, моль 3,5 масса ? формула вещества febr2 n, моль ? m, г 108 Решите подробно,…
Задача по химии Формула вещества aipo4 n, моль 3,5 масса ? формула вещества febr2 n, моль ? m, г 108 Решите подробно, а не просто в одну строчку, заранее спасибо
Ответ на вопрос
Для решения задачи нам необходимо определить массу веществ, используя их молекулярные формулы и количество моль.1. Вещество: ( AlPO_4 )Дано:Формула вещества: ( AlPO_4 ) Количество моль: ( n = 3.5 )Шаг 1: Определим молекулярную массу ( AlPO_4 ):Масса алюминия (Al): ( 26.98 ) г/моль Масса фосфора (P): ( 30.97 ) г/моль Масса кислорода (O): ( 16.00 ) г/моль Теперь найдем молекулярную массу вещества ( AlPO_4 ):[
\text{Молекулярная масса } AlPO_4 = (1 \cdot 26.98) + (1 \cdot 30.97) + (4 \cdot 16.00) = 26.98 + 30.97 + 64.00 = 121.95 \, г/моль
]Шаг 2: Найдем массу вещества:
Используем формулу для расчета массы:[
m = n \cdot M
]где:( m ) - масса,( n ) - количество моль (3.5),( M ) - молекулярная масса (121.95 г/моль).Подставим известные значения:[
m = 3.5 \cdot 121.95 = 426.825 \, г
]Итак, масса вещества ( AlPO_4 ) составляет примерно ( 426.83 ) г.2. Вещество: ( FeBr_2 )Дано:Формула вещества: ( FeBr_2 ) Масса: ( m = 108 ) г Не указано количество моль.Шаг 1: Определим молекулярную массу ( FeBr_2 ):Масса железа (Fe): ( 55.85 ) г/моль Масса брома (Br): ( 79.90 ) г/моль Теперь найдем молекулярную массу вещества ( FeBr_2 ):[
\text{Молекулярная масса } FeBr_2 = (1 \cdot 55.85) + (2 \cdot 79.90) = 55.85 + 159.80 = 215.65 \, г/моль
]Шаг 2: Найдем количество моль вещества:
Используем ту же формулу, но теперь для подсчета количества моль:[
n = \frac{m}{M}
]Подставим известные значения:[
n = \frac{108}{215.65} \approx 0.500 \, моль
]Итоги:Масса вещества ( AlPO_4 ) составляет примерно ( 426.83 ) г для ( 3.5 ) моль.Количество моль вещества ( FeBr_2 ) составляет примерно ( 0.500 ) моль для массы ( 108 ) г.
Еще
41
1
Указать степени окисления атомов в соединениях AIPO4, Ba(OH)2
Указать степени окисления атомов в соединениях AIPO4, Ba(OH)2
140
+1
1
Какая валентность у кислотных остатков, входящих в состав солей, формулы которых MgBr2; Ca3(PO4)2; KMnO4;…
валентность у кислотных остатков, входящих в состав солей, формулы которых MgBr2; Ca3(PO4)2; KMnO4; Na2CO3; AIPO4; CuSO4; Fe(NO3)3; IA2S3; PbCI4; KI ?
Ответ на вопрос
1) MgBr2 - кислотный остаток Br^- имеет валентность -1.
2) Ca3(PO4)2 - кислотный остаток PO4^3- имеет валентность -3.
3) KMnO4 - кислотный остаток MnO4^- имеет валентность -1.
4) Na2CO3 - кислотные остатки CO3^2- и Na^+ имеют валентность -2 и +1 соответственно.
5) AlPO4 - кислотный остаток PO4^3- имеет валентность -3.
6) CuSO4 - кислотный остаток SO4^2- имеет валентность -2.
7) Fe(NO3)3 - кислотный остаток NO3^- имеет валентность -1.
8) I2S3 - кислотный остаток S3^2- имеет валентность -2.
9) PbCl4 - кислотный остаток Cl^- имеет валентность -1.
10) KI - кислотный остаток I^- имеет валентность -1.
Еще
368
1
Каких из указаных формул допушена ошибка при написание BaSO4,AgCi.,AIPO4 ,NAOH
Каких из указаных формул допушена ошибка при написание BaSO4,AgCi.,AIPO4 ,NAOH
Ответ на вопрос
Формула для BaSO4 и AgCl написана верно.Однако формула для AIPO4 содержит ошибку - правильно будет AlPO4.Формула для NaOH также содержит ошибку - правильно будет NaOH.
Еще
169
1
Рассчитайте относительную молекулярную массу AIPO4, CASiO3, Na2SO3
Рассчитайте относительную молекулярную массу AIPO4, CASiO3, Na2SO3
Ответ на вопрос
Относительные молекулярные массы AIPO4, CASiO3, Na2SO3 можно найти складывая атомные массы всех элементов, входящих в молекулу, умножая их на соответствующие коэффициенты и складывая результаты.AIPO4:Атомные массы элементов: Al (алюминий) - 26.98, P (фосфор) - 30.97, O (кислород) - 16.00.Рассчитаем молекулярную массу AIPO4:
26.98(Al) + 30.97(P) + 4 * 16.00(O) = 121.93 г/мольCASiO3:Атомные массы элементов: Ca (кальций) - 40.08, Si (кремний) - 28.09, O (кислород) - 16.00.Рассчитаем молекулярную массу CASiO3:
40.08(Ca) + 28.09(Si) + 3 * 16.00(O) = 100.17 г/мольNa2SO3:Атомные массы элементов: Na (натрий) - 22.99, S (сера) - 32.06, O (кислород) - 16.00.Рассчитаем молекулярную массу Na2SO3:
2 22.99(Na) + 32.06(S) + 3 16.00(O) = 126.04 г/мольИтак, относительные молекулярные массы AIPO4, CASiO3, Na2SO3 равны: 121.93 г/моль, 100.17 г/моль, 126.04 г/моль соответственно.
Еще
135
1
Напишите ии уравняйте реакции:a) Li + H2О=б) Mn + Н2О=в) Ni + CdО =г) K+ Zn(NO3)2 =д) Са+ AIPO4=…
Напишите ии уравняйте реакции:a) Li + H2О=б) Mn + Н2О=в) Ni + CdО =г) K+ Zn(NO3)2 =д) Са+ AIPO4=
Ответ на вопрос
a) 2Li + 2H2O = 2LiOH + H2б) 3Mn + 4H2O = 3MnO2 + 4H2в) 2Ni + CdO = 2NiO + Cdг) 2K + Zn(NO3)2 = 2KNO3 + Znд) 3Ca + 2AlPO4 = Al2(CaPO4)3
Еще
162
1
Какая валентность у кислотных остатков, входящих в состав солей, формулы которых MgBr2; Ca3(PO4)2; KMnO4;…
валентность у кислотных остатков, входящих в состав солей, формулы которых MgBr2; Ca3(PO4)2; KMnO4; Na2CO3; AIPO4; CuSO4; Fe(NO3)3; IA2S3; PbCI4; KI ?
Ответ на вопрос
Все перечисленные соли содержат ионы, которые образованы кислотными остатками. Кислотные остатки могут иметь различную валентность в зависимости от ионной формулы. MgBr2 - ион бромида имеет валентность -1, значит кислотный остаток (Br) имеет валентность -1. Ca3(PO4)2 - ион фосфата (PO4) имеет валентность -3, значит кислотный остаток (PO4) также имеет валентность -3. KMnO4 - ион марганца в данном соединении имеет валентность +7, значит кислотный остаток (MnO4) имеет валентность -1. Na2CO3 - ион карбоната имеет валентность -2, значит кислотный остаток (CO3) имеет валентность -2.AlPO4 - ион фосфата (PO4) имеет валентность -3, значит кислотный остаток (PO4) также имеет валентность -3.CuSO4 - ион сульфата имеет валентность -2, значит кислотный остаток (SO4) также имеет валентность -2.Fe(NO3)3 - ион нитрата имеет валентность -1, значит кислотный остаток (NO3) также имеет валентность -1.As2S3 - ион серы в данном соединении имеет валентность -2, значит кислотный остаток (S) имеет валентность -2.PbCl4 - ион хлорида имеет валентность -1, значит кислотный остаток (Cl) также имеет валентность -1.KI - ион иода имеет валентность -1, значит кислотный остаток (I) также имеет валентность -1.
Еще
1 208
1
Вычислить относительную молекулярную массу AL2O3 CrSO4 BaCO3 AIPO4 CU(OH)2 MG3B2 Fe3O4 CaCO3 BaSO4 Cr(OH)3…
Вычислить относительную молекулярную массу AL2O3 CrSO4 BaCO3 AIPO4 CU(OH)2 MG3B2 Fe3O4 CaCO3 BaSO4 Cr(OH)3 AL(NO3)3 Mg3(PO4)2 Cr2(SO4)3 (NH4)2SO4 Cr(OH3)2 (NH4)2HPO4 HG(NO3)2 Cr(SiO3)3
Ответ на вопрос
Относительная молекулярная масса каждого соединения вычисляется путем сложения атомных масс каждого атома в молекуле.AL2O3: 2(Al) + 3(O) = 2(26.98) +3(16.00) = 101.96 g/mol
CrSO4: Cr + 1(S) + 4(O) = 52.00 + 32.06 + 4(16.00) = 159.06 g/mol
BaCO3: Ba + C + 3(O) = 137.33 + 12.01 + 3(16.00) = 197.34 g/mol
AlPO4: Al + P + 4(O) = 26.98 + 30.97 + 4(16.00) = 121.97 g/mol
Cu(OH)2: Cu + 2(O) + 2(H) = 63.55 + 2(16.00) + 2(1.01) = 97.56 g/mol
Mg3B2: 3(Mg) + 2(B) = 3(24.31) + 2(10.81) = 94.00 g/mol
Fe3O4: 3(Fe) + 4(O) = 3(55.85) + 4(16.00) = 231.52 g/mol
CaCO3: Ca + C + 3(O) = 40.08 + 12.01 + 3(16.00) = 100.09 g/mol
BaSO4: Ba + S + 4(O) = 137.33 + 32.06 + 4(16.00) = 233.33 g/mol
Cr(OH)3: Cr + 3(O) + 3(H) = 52.00 + 3(16.00) + 3(1.01) = 101.03 g/mol
Al(NO3)3: Al + 3(N) + 9(O) = 26.98 + 3(14.01) + 9(16.00) = 213.00 g/mol
Mg3(PO4)2: 3(Mg) + 2(P) + 8(O) = 3(24.31) + 2(30.97) + 8(16.00) = 262.88 g/mol
Cr2(SO4)3: 2(Cr) + 3(S) + 12(O) = 2(52.00) + 3(32.06) + 12(16.00) = 392.18 g/mol
(NH4)2SO4: 2(NH4) + S + 4(O) = 2(18.04) + 32.06 + 4(16.00) = 132.14 g/mol
Cr(OH3)2: Cr + 3(O) + 2(H) = 52.00 + 3(16.00) + 2(1.01) = 95.03 g/mol
(NH4)2HPO4: 2(NH4) + H + P + 4(O) = 2(18.04) + 1.01 + 30.97 + 4(16.00) = 132.06 g/mol
Hg(NO3)2: Hg + 2(N) + 6(O) = 200.59 + 2(14.01) + 6(16.00) = 324.56 g/mol
Cr(SiO3)3: Cr + 3(Si) + 9(O) = 52.00 + 3(28.09) + 9(16.00) = 308.27 g/molТаким образом, относительная молекулярная масса каждого соединения составляет:
AL2O3 - 101.96 g/mol
CrSO4 - 159.06 g/mol
BaCO3 - 197.34 g/mol
AlPO4 - 121.97 g/mol
Cu(OH)2 - 97.56 g/mol
Mg3B2 - 94.00 g/mol
Fe3O4 - 231.52 g/mol
CaCO3 - 100.09 g/mol
BaSO4 - 233.33 g/mol
Cr(OH)3 - 101.03 g/mol
Al(NO3)3 - 213.00 g/mol
Mg3(PO4)2 - 262.88 g/mol
Cr2(SO4)3 - 392.18 g/mol
(NH4)2SO4 - 132.14 g/mol
Cr(OH3)2 - 95.03 g/mol
(NH4)2HPO4 - 132.06 g/mol
Hg(NO3)2 - 324.56 g/mol
Cr(SiO3)3 - 308.27 g/mol
Еще
395
1
Что часто ищут
Поможем написать учебную работу